- MAGNÉTOCHIMIE
- MAGNÉTOCHIMIELes propriétés magnétiques sont intimement liées à la structure de la matière, à l’échelle moléculaire, et l’on conçoit que l’étude de ces propriétés a pu jouer un grand rôle dans l’élaboration des théories modernes de l’atome (effet Zeeman, par exemple) et continue à rendre de grands services dans la recherche d’une meilleure connaissance des structures moléculaires, géométriques et électroniques.L’ensemble de tels travaux, qui consistent dans un premier temps à rechercher les relations existant entre le magnétisme des composés et leur structure microscopique, ensuite à utiliser ces résultats pour résoudre les problèmes de structure les plus variés, a reçu le nom de magnétochimie.Il est apparu que les propriétés magnétiques pouvaient trouver des applications intéressantes dans des domaines de la chimie autres que ceux de la chimie structurale: séparation des minerais de fer, chimie analytique.En ce qui concerne la chimie analytique, on a pu mettre au point et même parfois commercialiser des appareils permettant dans certains cas favorables une analyse rapide, précise et non destructive; par exemple, pour le dosage de l’oxygène dans les gaz, des métaux dans les verres, du carbone dans les aciers.Le regroupement de ces études sous un même mot «magnétochimie» ne doit pas faire oublier la richesse et la diversité des techniques magnétochimiques, qui proviennent en particulier de l’origine très différente du diamagnétisme, du paramagnétisme, du ferromagnétisme ou de l’antiferromagnétisme, ainsi que de l’imagination des chercheurs.Le diamagnétisme, lié à un moment magnétique induit correspondant au mouvement orbital des électrons, est caractérisé par une susceptibilité de l’ordre de 漣 0,5.10-6 u.é.m. C.G.S. pratiquement indépendante du champ magnétique et de la température.Ce diamagnétisme, propriété universelle de la matière, est quelquefois masqué par suite de l’existence de moments magnétiques permanents à l’échelle atomique ou moléculaire, liée le plus souvent au spin des électrons. Lorsque le couplage entre ces moments atomiques ou moléculaires est faible, le composé est dit paramagnétique: la susceptibilité macroscopique par gramme est encore indépendante du champ magnétique, mais elle est alors positive et varie approximativement de façon inversement proportionnelle à la température; elle est de l’ordre de 10-4 u.é.m. C.G.S. à la température ordinaire.Au contraire, si ce couplage est fort, il se produit un effet de groupe: les moments atomiques tendent à s’orienter les uns par rapport aux autres même en l’absence de champ extérieur. Dans les composés ferromagnétiques, l’orientation est de même sens, ce qui produit un moment magnétique macroscopique permanent. La susceptibilité par gramme est alors de l’ordre de 10-2 u.é.m. C.G.S.; elle dépend de la température et du champ magnétique. Dans les composés antiferromagnétiques, le couplage tend au contraire à annuler les moments atomiques deux à deux; la susceptibilité positive est alors très faible (10-7 à 10-5 u.é.m. C.G.S.) et croît avec la température.D’autres effets faisant intervenir le champ magnétique peuvent également être utilisés pour élucider certaines structures ou réaliser des analyses chimiques: la biréfringence magnétique, le pouvoir rotatoire magnétique; mais il semble que ce soient les techniques fondées sur les phénomènes de résonance magnétique nucléaire et électronique qui ont donné lieu aux applications les plus intéressantes: la résonance nucléaire dans le domaine des molécules diamagnétiques et, à un degré moindre, la résonance électronique dans le domaine des composés paramagnétiques. On peut noter qu’à l’heure actuelle pratiquement tous les laboratoires de chimie organique sont équipés d’un appareil de résonance nucléaire utilisé, systématiquement, pour l’étude structurale des composés préparés.1. Structure des molécules diamagnétiquesApplication de la loi d’additivité de PascalL’établissement et l’utilisation de la loi d’additivité des susceptibilités diamagnétiques par Paul Pascal font de lui un des créateurs de la magnétochimie moderne.D’après cette loi, la susceptibilité magnétique d’une molécule 﨑M est égale à la somme des susceptibilités 﨑A des atomes qui la constituent, corrigée éventuellement d’incréments caractérisant certaines particularités moléculaires:
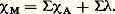 Elle est généralement bien satisfaite (à 1 ou 2 p. 100 près) et a pu être utilisée pour la détermination de structures moléculaires.Un cas favorable est celui où l’on hésite entre deux formules correspondant à des susceptibilités calculées suffisamment différentes. Cela se produit, en particulier, lorsque l’une des structures présente un caractère aromatique; en effet, dans le cas du benzène par exemple, la susceptibilité molaire mesurée 﨑M est égale à 漣 55,1 . 10-6 u.é.m., alors que la susceptibilité calculée pour un modèle moléculaire hypothétique supposé sans conjugaison est:
Elle est généralement bien satisfaite (à 1 ou 2 p. 100 près) et a pu être utilisée pour la détermination de structures moléculaires.Un cas favorable est celui où l’on hésite entre deux formules correspondant à des susceptibilités calculées suffisamment différentes. Cela se produit, en particulier, lorsque l’une des structures présente un caractère aromatique; en effet, dans le cas du benzène par exemple, la susceptibilité molaire mesurée 﨑M est égale à 漣 55,1 . 10-6 u.é.m., alors que la susceptibilité calculée pour un modèle moléculaire hypothétique supposé sans conjugaison est: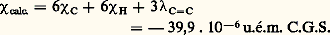 (cf. DIAMAGNÉTISME). La différence:
(cf. DIAMAGNÉTISME). La différence: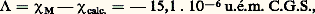 caractéristique de l’aromaticité, représente 27,5 p. 100 de la susceptibilité.Un calcul analogue effectué pour la molécule de cyclooctatétraène conduit à:
caractéristique de l’aromaticité, représente 27,5 p. 100 de la susceptibilité.Un calcul analogue effectué pour la molécule de cyclooctatétraène conduit à: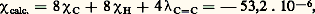 valeur proche de la susceptibilité molaire 﨑M = 漣 51,9 . 10-6 et qui montre l’absence de conjugaison dans cette molécule pour laquelle on aurait pu s’attendre à une structure analogue à celle du benzène. Une étude du cristal aux rayons X a, d’autre part, confirmé que le cyclooctatétraène n’était pas plan et que, par conséquent, la conjugaison devait y être réduite.De façon analogue, on pouvait hésiter sur la formule 1 a ou 1 b à attribuer à l’acide cyanurique. La mesure de la susceptibilité magnétique de l’acide cyanurique permet de montrer que seule la formule 1 a est compatible avec le diamagnétisme élevé de cette molécule. Quand les différences entre les susceptibilités calculées sont plus faibles, l’interprétation des résultats est plus délicate.L’accord très satisfaisant entre les susceptibilités calculées et mesurées d’un très grand nombre de composés organiques montre que cette grandeur est en fait assez peu sensible à un grand nombre de particularités de structures ou aux interactions moléculaires, de telle sorte que, si ces études ont pu apporter des éclaircissements intéressants sur les structures moléculaires dans la première moitié du siècle, elles sont supplantées actuellement par les techniques de résonance magnétique nucléaire qui fournissent des renseignements beaucoup plus variés que la seule valeur d’une susceptibilité magnétique moyenne et qui sont beaucoup plus sensibles aux caractéristiques propres à chaque molécule.Résonance magnétique nucléaire (R.M.N.)Les spectres de résonance nucléaire mettent en évidence les différences d’énergie des spins nucléaires des molécules en présence d’un champ magnétique. Les raies spectrales correspondantes qui se trouvent dans le domaine hertzien pour des champs de quelques milliers de gauss permettent d’atteindre deux grandeurs moléculaires importantes:– Les déplacements chimiques (chemical shifts ), qui sont dus à la création de champs magnétiques locaux, légèrement différents du champ magnétique appliqué, liés au moment diamagnétique induit de la molécule. La méthode est très sensible à de toutes petites modifications de ce champ local, de telle sorte que les raies de résonance de chaque noyau dépendent fortement de leur environnement chimique.– Les constantes de couplage nucléaire , caractéristiques des interactions énergétiques d’origine magnétique entre noyaux, qui ont pour effet de décomposer de manière plus ou moins compliquée chaque raie de résonance en un certain nombre de raies.Le nombre et l’intensité relative des raies ainsi formées donnent des indications sur la présence des noyaux voisins.Ces méthodes permettent d’observer les effets dus aux noyaux possédant un moment magnétique nucléaire. Le noyau de beaucoup le plus étudié est le proton 1H dont les spectres fournissent des renseignements particulièrement précieux en chimie organique, mais les noyaux de 11B, 13C, 14N, 17O, 19F, 29Si, 31P, 59Co et 207Pb ont également été étudiés avec succès.Il n’est pas possible de détailler ici les différentes applications de la résonance nucléaire à la chimie, mais les commentaires suivants sur le spectre des protons du bromure d’éthyle CH3 漣CH2 漣Br peuvent donner une idée de la puissance de la méthode en ce qui concerne les problèmes de structure (fig. 1).Ce spectre se compose de deux groupes de raies A et B attribuées respectivement aux protons des groupements CH2 et CH3. Son interprétation fait apparaître les points suivants:– Le rapport des intensités de ces deux groupes de raies est égal au rapport du nombre de protons de chaque groupe, soit 3/2.– La décomposition des raies du groupe A est liée directement aux orientations possibles des spins des trois protons du groupe CH3 voisin. Le nombre de raies est égal au nombre de valeurs différentes que peut prendre la composante FZ du moment cinétique de spin des protons du groupe CH3, soit 4 (3/2, 1/2, 漣 1/2, 漣 3/2). Les intensités relatives sont dans le rapport du nombre d’états de spin correspondant aux valeurs de FZ , soit 1: 3: 3: 1.De la même façon, la décomposition des raies du groupe B est due aux deux protons du groupe CH2 voisin. On observe un triplet correspondant aux trois valeurs possibles de FZ (1, 0, 漣 1) dont les intensités sont dans le rapport 1: 2: 1.– La constante de couplage JAB est donnée directement par l’écart entre deux raies consécutives du groupe A et du groupe B. Les déplacements chimiques 嗀A et 嗀B déterminés par rapport à la raie d’un composé de référence qui résonne au champ HR sont donnés par les expressions:
valeur proche de la susceptibilité molaire 﨑M = 漣 51,9 . 10-6 et qui montre l’absence de conjugaison dans cette molécule pour laquelle on aurait pu s’attendre à une structure analogue à celle du benzène. Une étude du cristal aux rayons X a, d’autre part, confirmé que le cyclooctatétraène n’était pas plan et que, par conséquent, la conjugaison devait y être réduite.De façon analogue, on pouvait hésiter sur la formule 1 a ou 1 b à attribuer à l’acide cyanurique. La mesure de la susceptibilité magnétique de l’acide cyanurique permet de montrer que seule la formule 1 a est compatible avec le diamagnétisme élevé de cette molécule. Quand les différences entre les susceptibilités calculées sont plus faibles, l’interprétation des résultats est plus délicate.L’accord très satisfaisant entre les susceptibilités calculées et mesurées d’un très grand nombre de composés organiques montre que cette grandeur est en fait assez peu sensible à un grand nombre de particularités de structures ou aux interactions moléculaires, de telle sorte que, si ces études ont pu apporter des éclaircissements intéressants sur les structures moléculaires dans la première moitié du siècle, elles sont supplantées actuellement par les techniques de résonance magnétique nucléaire qui fournissent des renseignements beaucoup plus variés que la seule valeur d’une susceptibilité magnétique moyenne et qui sont beaucoup plus sensibles aux caractéristiques propres à chaque molécule.Résonance magnétique nucléaire (R.M.N.)Les spectres de résonance nucléaire mettent en évidence les différences d’énergie des spins nucléaires des molécules en présence d’un champ magnétique. Les raies spectrales correspondantes qui se trouvent dans le domaine hertzien pour des champs de quelques milliers de gauss permettent d’atteindre deux grandeurs moléculaires importantes:– Les déplacements chimiques (chemical shifts ), qui sont dus à la création de champs magnétiques locaux, légèrement différents du champ magnétique appliqué, liés au moment diamagnétique induit de la molécule. La méthode est très sensible à de toutes petites modifications de ce champ local, de telle sorte que les raies de résonance de chaque noyau dépendent fortement de leur environnement chimique.– Les constantes de couplage nucléaire , caractéristiques des interactions énergétiques d’origine magnétique entre noyaux, qui ont pour effet de décomposer de manière plus ou moins compliquée chaque raie de résonance en un certain nombre de raies.Le nombre et l’intensité relative des raies ainsi formées donnent des indications sur la présence des noyaux voisins.Ces méthodes permettent d’observer les effets dus aux noyaux possédant un moment magnétique nucléaire. Le noyau de beaucoup le plus étudié est le proton 1H dont les spectres fournissent des renseignements particulièrement précieux en chimie organique, mais les noyaux de 11B, 13C, 14N, 17O, 19F, 29Si, 31P, 59Co et 207Pb ont également été étudiés avec succès.Il n’est pas possible de détailler ici les différentes applications de la résonance nucléaire à la chimie, mais les commentaires suivants sur le spectre des protons du bromure d’éthyle CH3 漣CH2 漣Br peuvent donner une idée de la puissance de la méthode en ce qui concerne les problèmes de structure (fig. 1).Ce spectre se compose de deux groupes de raies A et B attribuées respectivement aux protons des groupements CH2 et CH3. Son interprétation fait apparaître les points suivants:– Le rapport des intensités de ces deux groupes de raies est égal au rapport du nombre de protons de chaque groupe, soit 3/2.– La décomposition des raies du groupe A est liée directement aux orientations possibles des spins des trois protons du groupe CH3 voisin. Le nombre de raies est égal au nombre de valeurs différentes que peut prendre la composante FZ du moment cinétique de spin des protons du groupe CH3, soit 4 (3/2, 1/2, 漣 1/2, 漣 3/2). Les intensités relatives sont dans le rapport du nombre d’états de spin correspondant aux valeurs de FZ , soit 1: 3: 3: 1.De la même façon, la décomposition des raies du groupe B est due aux deux protons du groupe CH2 voisin. On observe un triplet correspondant aux trois valeurs possibles de FZ (1, 0, 漣 1) dont les intensités sont dans le rapport 1: 2: 1.– La constante de couplage JAB est donnée directement par l’écart entre deux raies consécutives du groupe A et du groupe B. Les déplacements chimiques 嗀A et 嗀B déterminés par rapport à la raie d’un composé de référence qui résonne au champ HR sont donnés par les expressions: ils sont de l’ordre de 10-6 et exprimés habituellement en «parties par million» (p.p.m.).Bien entendu, les spectres obtenus sont souvent plus compliqués que celui de l’exemple précédent et leur interprétation plus difficile. Cependant, dans un grand nombre de cas, ils peuvent fournir des indications très précieuses sur les structures moléculaires. En particulier, les déplacements chimiques des différents groupes de protons permettent de reconnaître (fig. 2) les groupes fonctionnels présents dans une molécule et les intensités relatives, le nombre de ces groupes fonctionnels. En outre, la structure en multiplet due au couplage spin-spin donne des précisions sur les protons voisins, et la valeur des constantes de couplage en donne sur l’éloignement de ces protons. Ces spectres sont également sensibles aux interactions moléculaires et, en particulier, à la présence de liaisons hydrogènes.Un autre domaine où la résonance magnétique nucléaire apporte des renseignements intéressants est celui des mouvements moléculaires et des durées de vie des espèces moléculaires. On n’observe, en réalité, des spectres aussi détaillés appelés «spectres de haute résolution» que lorsque les molécules sont libres de s’orienter très rapidement suivant toutes les directions de l’espace. S’il n’en est pas ainsi, par suite de la viscosité du milieu ou tout simplement par suite de la rigidité d’un édifice cristallin, les raies s’élargissent (leur largeur peut atteindre quelques gauss au lieu de quelques milligauss) et le spectre est alors dit «de faible résolution». Bien entendu, une grande partie des informations que l’on peut tirer d’un spectre de haute résolution ont disparu, mais ces spectres peuvent alors être utilisés pour étudier les mouvements moléculaires dans les solides, ou pour déterminer la position des protons dans un cristal. La résonance magnétique nucléaire est, dans ce dernier cas, complémentaire des techniques de rayons X qui ne mettent que difficilement en évidence les atomes d’hydrogène.En ce qui concerne le problème des durées de vie, on peut citer l’exemple du spectre de haute résolution de l’alcool éthylique. Dans le spectre de l’alcool éthylique pur anhydre, on observe normalement un triplet correspondant à la présence des protons du groupe CH2 voisin. Si l’on ajoute une petite quantité d’eau, ce spectre est profondément modifié et ce triplet est remplacé par une raie fine. Cette modification est due à l’échange très rapide de ces protons avec ceux de l’eau. La durée de vie de la liaison O 漣H est alors inférieure à la période de l’onde électromagnétique utilisée pour détecter la résonance nucléaire (10-8 s pour une fréquence de 100 MHz).Les «temps de relaxation» qui caractérisent le retour à l’équilibre après une excitation magnétique donnée et qui sont liés aux échanges d’énergie à l’échelle moléculaire sont également utilisés.2. Radicaux libres et biradicauxCertains composés, appelés radicaux libres, provenant le plus souvent de la dissociation de molécules organiques ou organo-métalliques comportent un nombre impair d’électrons. L’existence d’un électron non apparié conduit à un paramagnétisme de spin caractérisé par une susceptibilité molaire positive qui masque complètement le diamagnétisme:
ils sont de l’ordre de 10-6 et exprimés habituellement en «parties par million» (p.p.m.).Bien entendu, les spectres obtenus sont souvent plus compliqués que celui de l’exemple précédent et leur interprétation plus difficile. Cependant, dans un grand nombre de cas, ils peuvent fournir des indications très précieuses sur les structures moléculaires. En particulier, les déplacements chimiques des différents groupes de protons permettent de reconnaître (fig. 2) les groupes fonctionnels présents dans une molécule et les intensités relatives, le nombre de ces groupes fonctionnels. En outre, la structure en multiplet due au couplage spin-spin donne des précisions sur les protons voisins, et la valeur des constantes de couplage en donne sur l’éloignement de ces protons. Ces spectres sont également sensibles aux interactions moléculaires et, en particulier, à la présence de liaisons hydrogènes.Un autre domaine où la résonance magnétique nucléaire apporte des renseignements intéressants est celui des mouvements moléculaires et des durées de vie des espèces moléculaires. On n’observe, en réalité, des spectres aussi détaillés appelés «spectres de haute résolution» que lorsque les molécules sont libres de s’orienter très rapidement suivant toutes les directions de l’espace. S’il n’en est pas ainsi, par suite de la viscosité du milieu ou tout simplement par suite de la rigidité d’un édifice cristallin, les raies s’élargissent (leur largeur peut atteindre quelques gauss au lieu de quelques milligauss) et le spectre est alors dit «de faible résolution». Bien entendu, une grande partie des informations que l’on peut tirer d’un spectre de haute résolution ont disparu, mais ces spectres peuvent alors être utilisés pour étudier les mouvements moléculaires dans les solides, ou pour déterminer la position des protons dans un cristal. La résonance magnétique nucléaire est, dans ce dernier cas, complémentaire des techniques de rayons X qui ne mettent que difficilement en évidence les atomes d’hydrogène.En ce qui concerne le problème des durées de vie, on peut citer l’exemple du spectre de haute résolution de l’alcool éthylique. Dans le spectre de l’alcool éthylique pur anhydre, on observe normalement un triplet correspondant à la présence des protons du groupe CH2 voisin. Si l’on ajoute une petite quantité d’eau, ce spectre est profondément modifié et ce triplet est remplacé par une raie fine. Cette modification est due à l’échange très rapide de ces protons avec ceux de l’eau. La durée de vie de la liaison O 漣H est alors inférieure à la période de l’onde électromagnétique utilisée pour détecter la résonance nucléaire (10-8 s pour une fréquence de 100 MHz).Les «temps de relaxation» qui caractérisent le retour à l’équilibre après une excitation magnétique donnée et qui sont liés aux échanges d’énergie à l’échelle moléculaire sont également utilisés.2. Radicaux libres et biradicauxCertains composés, appelés radicaux libres, provenant le plus souvent de la dissociation de molécules organiques ou organo-métalliques comportent un nombre impair d’électrons. L’existence d’un électron non apparié conduit à un paramagnétisme de spin caractérisé par une susceptibilité molaire positive qui masque complètement le diamagnétisme: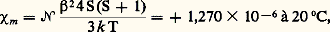 où 類, 廓, k et T représentent respectivement le nombre d’Avogadro, le magnéton de Bohr, la constante de Boltzmann et la température absolue et où S = 1/2 est le nombre quantique de spin.La mesure de la susceptibilité magnétique constitue une méthode de choix pour mettre en évidence ou pour doser les radicaux libres. Il suffit d’appliquer la «loi des mélanges», en tenant compte de la partie diamagnétique grâce à la loi d’additivité de Pascal. C’est ainsi que l’on a pu étudier en solution la dissociation des dérivés de l’hexaphényléthane en dérivés du radical triphénylméthyl:
où 類, 廓, k et T représentent respectivement le nombre d’Avogadro, le magnéton de Bohr, la constante de Boltzmann et la température absolue et où S = 1/2 est le nombre quantique de spin.La mesure de la susceptibilité magnétique constitue une méthode de choix pour mettre en évidence ou pour doser les radicaux libres. Il suffit d’appliquer la «loi des mélanges», en tenant compte de la partie diamagnétique grâce à la loi d’additivité de Pascal. C’est ainsi que l’on a pu étudier en solution la dissociation des dérivés de l’hexaphényléthane en dérivés du radical triphénylméthyl: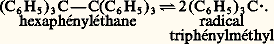 Ces radicaux libres sont d’autant plus stables qu’ils correspondent à des systèmes plus conjugués, et il existe des radicaux stables à l’état pur cristallisé. C’est le cas du pentaphénylcyclopentadiényl (formule 2) et du diphénylpicrylhydrazyl ou D.P.P.H. (formule 3) qui est souvent utilisé comme étalon dans les mesures de résonance paramagnétique électronique. La mesure de la susceptibilité magnétique constitue alors un critère de pureté intéressant.La résonance paramagnétique électronique a apporté une aide particulièrement précieuse à l’étude de ces radicaux libres, par suite de sa grande sensibilité, d’une part, et des renseignements fournis par la «structure hyperfine » de ces spectres, d’autre part. En effet, les appareils actuels permettent de détecter la présence de 1011 à 1013 centres paramagnétiques dans un volume de l’ordre de 1 cm3, soit une concentration de 10-10 à 10-8 mole par litre, ce qui dépasse largement ce que peuvent donner les mesures les plus sensibles de magnétisme statique. De plus, les interactions (ou couplages) entre le spin électronique et les spins nucléaires produisent une décomposition complexe des raies de résonance appelée structure hyperfine et caractéristique du nombre et de la nature des noyaux présents dans le radical. De façon plus précise, un radical comprenant n noyaux de spin I conduira à 2n I + 1 raies dont la position est directement liée aux constantes de couplage entre l’électron non apparié et chaque noyau, ces constantes de couplage étant elles-mêmes proportionnelles à la densité électronique correspondant à cet électron au voisinage de chacun de ces noyaux. On conçoit donc l’intérêt de ces spectres pour l’établissement des structures et l’étude de ces radicaux.Certaines molécules présentent un paramagnétisme de spin, bien qu’elles possèdent un nombre pair d’électrons; elles sont appelées biradicaux (fig. 3).La molécule d’oxygène, qui est un des biradicaux les plus simples, contient deux électrons fortement couplés à spins parallèles. Dans les biradicaux organiques, au contraire, les deux électrons responsables du paramagnétisme ont tendance à s’éloigner au maximum l’un de l’autre; leur couplage étant faible, il en résulte une susceptibilité paramagnétique qui est le double de celle d’un radical libre.Les molécules diamagnétiques dans l’état fondamental se comportent dans certains états excités (états triplets) comme des biradicaux, et le phénomène de phosphorescence avait été expliqué en admettant le peuplement important de tels états sous l’action d’une lumière excitatrice. Des mesures magnétiques directes ont permis de vérifier cette hypothèse dans le cas de la fluorescéine et de nombreux composés aromatiques.3. Complexes de coordinationL’étude des complexes des métaux de transition offre une des plus intéressantes applications du magnétisme à l’étude des structures.Ces complexes peuvent être considérés comme formés par la fixation sur un atome ou un ion métallique central de molécules ou d’ions auxquels on donne le nom de ligands ou plus rarement de coordinats .Lorsque le couplage entre les ligands et cet ion central est suffisamment faible, ce dernier conserve son moment magnétique, formé par la combinaison d’un moment orbital et d’un moment de spin. C’est effectivement ce qui se passe pour les électrons 4f des ions des lanthanides. Mais souvent le moment orbital n’apparaît pas parce qu’il n’est pas libre de s’orienter dans le champ appliqué par suite d’un couplage important avec les ligands. Les complexes correspondants, corrigés de leur diamagnétisme, se présentent alors comme des composés paramagnétiques de moment effectif:
Ces radicaux libres sont d’autant plus stables qu’ils correspondent à des systèmes plus conjugués, et il existe des radicaux stables à l’état pur cristallisé. C’est le cas du pentaphénylcyclopentadiényl (formule 2) et du diphénylpicrylhydrazyl ou D.P.P.H. (formule 3) qui est souvent utilisé comme étalon dans les mesures de résonance paramagnétique électronique. La mesure de la susceptibilité magnétique constitue alors un critère de pureté intéressant.La résonance paramagnétique électronique a apporté une aide particulièrement précieuse à l’étude de ces radicaux libres, par suite de sa grande sensibilité, d’une part, et des renseignements fournis par la «structure hyperfine » de ces spectres, d’autre part. En effet, les appareils actuels permettent de détecter la présence de 1011 à 1013 centres paramagnétiques dans un volume de l’ordre de 1 cm3, soit une concentration de 10-10 à 10-8 mole par litre, ce qui dépasse largement ce que peuvent donner les mesures les plus sensibles de magnétisme statique. De plus, les interactions (ou couplages) entre le spin électronique et les spins nucléaires produisent une décomposition complexe des raies de résonance appelée structure hyperfine et caractéristique du nombre et de la nature des noyaux présents dans le radical. De façon plus précise, un radical comprenant n noyaux de spin I conduira à 2n I + 1 raies dont la position est directement liée aux constantes de couplage entre l’électron non apparié et chaque noyau, ces constantes de couplage étant elles-mêmes proportionnelles à la densité électronique correspondant à cet électron au voisinage de chacun de ces noyaux. On conçoit donc l’intérêt de ces spectres pour l’établissement des structures et l’étude de ces radicaux.Certaines molécules présentent un paramagnétisme de spin, bien qu’elles possèdent un nombre pair d’électrons; elles sont appelées biradicaux (fig. 3).La molécule d’oxygène, qui est un des biradicaux les plus simples, contient deux électrons fortement couplés à spins parallèles. Dans les biradicaux organiques, au contraire, les deux électrons responsables du paramagnétisme ont tendance à s’éloigner au maximum l’un de l’autre; leur couplage étant faible, il en résulte une susceptibilité paramagnétique qui est le double de celle d’un radical libre.Les molécules diamagnétiques dans l’état fondamental se comportent dans certains états excités (états triplets) comme des biradicaux, et le phénomène de phosphorescence avait été expliqué en admettant le peuplement important de tels états sous l’action d’une lumière excitatrice. Des mesures magnétiques directes ont permis de vérifier cette hypothèse dans le cas de la fluorescéine et de nombreux composés aromatiques.3. Complexes de coordinationL’étude des complexes des métaux de transition offre une des plus intéressantes applications du magnétisme à l’étude des structures.Ces complexes peuvent être considérés comme formés par la fixation sur un atome ou un ion métallique central de molécules ou d’ions auxquels on donne le nom de ligands ou plus rarement de coordinats .Lorsque le couplage entre les ligands et cet ion central est suffisamment faible, ce dernier conserve son moment magnétique, formé par la combinaison d’un moment orbital et d’un moment de spin. C’est effectivement ce qui se passe pour les électrons 4f des ions des lanthanides. Mais souvent le moment orbital n’apparaît pas parce qu’il n’est pas libre de s’orienter dans le champ appliqué par suite d’un couplage important avec les ligands. Les complexes correspondants, corrigés de leur diamagnétisme, se présentent alors comme des composés paramagnétiques de moment effectif: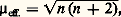 où n est le nombre d’électrons non appariés.Il existe, bien entendu, des cas intermédiaires pour lesquels la disparition du moment orbital est incomplète.Linus Pauling a proposé une théorie simple fondée sur la méthode des liaisons de valence et montrant la relation qui existe entre les propriétés magnétiques de ces complexes et leur structure géométrique.Soit l’exemple des complexes tétracoordinés du nickel: les ions complexes [Ni(NH3)4]2+ et [Ni(CN)4]2- peuvent être considérés tous les deux comme formés d’un ion nickel central Ni2+ sur lequel sont venus se fixer les ligands: quatre molécules d’ammoniac NH3 dans le premier, quatre ions cyanures C- dans le second.La configuration électronique de l’ion Ni2+ est 1s 2; 2s 2, 2p 6; 3s 2, 3p 6, 3d 8, dans l’état fondamental. En ce qui concerne les électrons externes, elle est représentée de façon plus précise sur la figure 4 a, qui montre de manière suggestive que trois des orbitales 3d sont occupées par deux électrons à spins antiparallèles et les deux autres par un électron chacune. Par suite du couplage de Hund, les spins de ces deux derniers électrons sont parallèles. Les orbitales 4s et 4p sont inoccupées.Pauling admet alors que chaque ligand est lié à l’ion nickel par suite de la mise en commun d’une paire libre dans une orbitale de liaison faisant intervenir les orbitales 4s et 4p , ce que l’on représente par des points placés dans les cases correspondantes.On arrive alors à la représentation 4 b. En réalité, ce ne sont pas les orbitales 4s et 4p qui interviennent, mais les orbitales hybrides sp 3 qui correspondent à un complexe de forme tétraédrique.La représentation précédente s’applique à l’ion [Ni(NH3)4]2+ qui a effectivement une structure tétraédrique et dont le moment effectif 猪eff. = 2,83 correspond bien à l’existence de deux électrons non appariés.Mais dans d’autres cas la présence des ligands peut faire disparaître l’effet du couplage de Hund, les spins des électrons de l’ion Ni2+ sont deux à deux antiparallèles, et l’on a le schéma 4 c.Les orbitales assurant la liaison avec les ligands peuvent alors être quatre orbitales hybrides dsp 2 (combinaisons linéaires des orbitales 3d xy , 4s , 4p x et 4p y ) qui forment quatre liaisons coplanaires suivant les diagonales d’un carré: c’est effectivement le cas pour l’ion [Ni(CN)4]2- dans lequel les ions C- sont situés au sommet d’un carré dont l’ion Ni2+ occupe le centre. L’expérience montre, en outre, que cet ion complexe est bien diamagnétique conformément à la répartition des spins de la représentation précédente.Les résultats spectaculaires, comme celui de la figure 5, de la théorie de Pauling correspondent en fait à des cas limites, et les moments effectifs peuvent être supérieurs ou inférieurs à ceux calculés en ne considérant que le nombre n de spins non appariés. Les théories du champ cristallin et du champ de ligands viennent la compléter, en analysant l’effet des ligands sur les électrons non liants des ions métalliques (principalement les électrons d représentés par des flèches dans les exemples précédents), en fonction de l’importance de l’interaction ligand-ion métallique.Elles permettent de montrer comment les états d’énergie des ions libres, caractérisés par leurs «termes spectroscopiques», sont modifiés par la présence de ces ligands. L’étude de l’action d’un champ magnétique sur ces nouveaux niveaux d’énergie et de l’occupation de ces niveaux avec la température permet de calculer la susceptibilité magnétique.4. Structure et propriétés magnétiques de l’état solideLes théories précédentes ne s’appliquent que si les moments magnétiques des différents ions s’orientent indépendamment les uns des autres. Dans d’autres cas, au contraire, il existe une énergie d’interaction de la forme:
où n est le nombre d’électrons non appariés.Il existe, bien entendu, des cas intermédiaires pour lesquels la disparition du moment orbital est incomplète.Linus Pauling a proposé une théorie simple fondée sur la méthode des liaisons de valence et montrant la relation qui existe entre les propriétés magnétiques de ces complexes et leur structure géométrique.Soit l’exemple des complexes tétracoordinés du nickel: les ions complexes [Ni(NH3)4]2+ et [Ni(CN)4]2- peuvent être considérés tous les deux comme formés d’un ion nickel central Ni2+ sur lequel sont venus se fixer les ligands: quatre molécules d’ammoniac NH3 dans le premier, quatre ions cyanures C- dans le second.La configuration électronique de l’ion Ni2+ est 1s 2; 2s 2, 2p 6; 3s 2, 3p 6, 3d 8, dans l’état fondamental. En ce qui concerne les électrons externes, elle est représentée de façon plus précise sur la figure 4 a, qui montre de manière suggestive que trois des orbitales 3d sont occupées par deux électrons à spins antiparallèles et les deux autres par un électron chacune. Par suite du couplage de Hund, les spins de ces deux derniers électrons sont parallèles. Les orbitales 4s et 4p sont inoccupées.Pauling admet alors que chaque ligand est lié à l’ion nickel par suite de la mise en commun d’une paire libre dans une orbitale de liaison faisant intervenir les orbitales 4s et 4p , ce que l’on représente par des points placés dans les cases correspondantes.On arrive alors à la représentation 4 b. En réalité, ce ne sont pas les orbitales 4s et 4p qui interviennent, mais les orbitales hybrides sp 3 qui correspondent à un complexe de forme tétraédrique.La représentation précédente s’applique à l’ion [Ni(NH3)4]2+ qui a effectivement une structure tétraédrique et dont le moment effectif 猪eff. = 2,83 correspond bien à l’existence de deux électrons non appariés.Mais dans d’autres cas la présence des ligands peut faire disparaître l’effet du couplage de Hund, les spins des électrons de l’ion Ni2+ sont deux à deux antiparallèles, et l’on a le schéma 4 c.Les orbitales assurant la liaison avec les ligands peuvent alors être quatre orbitales hybrides dsp 2 (combinaisons linéaires des orbitales 3d xy , 4s , 4p x et 4p y ) qui forment quatre liaisons coplanaires suivant les diagonales d’un carré: c’est effectivement le cas pour l’ion [Ni(CN)4]2- dans lequel les ions C- sont situés au sommet d’un carré dont l’ion Ni2+ occupe le centre. L’expérience montre, en outre, que cet ion complexe est bien diamagnétique conformément à la répartition des spins de la représentation précédente.Les résultats spectaculaires, comme celui de la figure 5, de la théorie de Pauling correspondent en fait à des cas limites, et les moments effectifs peuvent être supérieurs ou inférieurs à ceux calculés en ne considérant que le nombre n de spins non appariés. Les théories du champ cristallin et du champ de ligands viennent la compléter, en analysant l’effet des ligands sur les électrons non liants des ions métalliques (principalement les électrons d représentés par des flèches dans les exemples précédents), en fonction de l’importance de l’interaction ligand-ion métallique.Elles permettent de montrer comment les états d’énergie des ions libres, caractérisés par leurs «termes spectroscopiques», sont modifiés par la présence de ces ligands. L’étude de l’action d’un champ magnétique sur ces nouveaux niveaux d’énergie et de l’occupation de ces niveaux avec la température permet de calculer la susceptibilité magnétique.4. Structure et propriétés magnétiques de l’état solideLes théories précédentes ne s’appliquent que si les moments magnétiques des différents ions s’orientent indépendamment les uns des autres. Dans d’autres cas, au contraire, il existe une énergie d’interaction de la forme: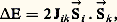 où le coefficient de proportionnalité Jik est appelé constante de couplage des spins 轢Si et 轢Sk . Suivant le signe de Jik , cette énergie d’interaction tend à rendre les spins parallèles ou antiparallèles. Lorsque la distance entre les ions paramagnétiques est faible ou encore lorsque les autres atomes transmettent cette interaction, l’énergie précédente peut être importante et, dans le cas des solides, on observe alors d’autres phénomènes: ferromagnétisme (spins parallèles), antiferromagnétisme (existence de deux ou plusieurs sous-réseaux correspondant à des spins orientés parallèlement).De tels composés contiennent toujours soit un métal de transition, soit un lanthanide, ou un élément de la famille des actinides; leurs propriétés magnétiques sont intimement liées à leur structure cristalline qui conditionne la nature et l’intensité de ces interactions [cf. FERRITES ET GRENATS].5. Analyse chimiqueL’utilisation d’un aimant pour la recherche des minerais de fer ferromagnétiques constitue sans doute la plus ancienne application du magnétisme à l’analyse chimique. On met à profit les forces importantes produites par un aimant sur les matériaux ferromagnétiques pour enrichir les minerais de fer. Si les particules riches en fer sont constituées de magnétite, les champs magnétiques utilisés sont de l’ordre de 0,3 tesla (séparation magnétique à basse intensité), tandis que les particules d’hématite nécessitent des champs de 0,2 tesla (séparation magnétique à haute intensité). Dans ce dernier cas, après broyage, on peut transformer d’abord Fe23 en Fe34 par un grillage dit «magnétisant», ce qui permet ensuite d’effectuer une séparation magnétique à basse intensité.Les techniques magnétiques sont intéressantes chaque fois qu’un des composants du mélange possède une susceptibilité très supérieure à celle des autres: c’est le cas, en particulier, d’un constituant paramagnétique ou ferromagnétique dans un mélange diamagnétique ou d’un constituant ferromagnétique dans un mélange paramagnétique. La variation des susceptibilités en fonction de la température et du champ magnétique apporte des indications complémentaires.La détermination quantitative de la composition d’un échantillon résulte le plus souvent de l’application de la loi des mélanges, ou loi de Wiedemann, d’après laquelle la susceptibilité massique 﨑 d’un mélange est liée aux susceptibilités massiques 﨑1, 﨑2, ... et aux pourcentages pondéraux P1, P2, ... de ses constituants par l’expression:
où le coefficient de proportionnalité Jik est appelé constante de couplage des spins 轢Si et 轢Sk . Suivant le signe de Jik , cette énergie d’interaction tend à rendre les spins parallèles ou antiparallèles. Lorsque la distance entre les ions paramagnétiques est faible ou encore lorsque les autres atomes transmettent cette interaction, l’énergie précédente peut être importante et, dans le cas des solides, on observe alors d’autres phénomènes: ferromagnétisme (spins parallèles), antiferromagnétisme (existence de deux ou plusieurs sous-réseaux correspondant à des spins orientés parallèlement).De tels composés contiennent toujours soit un métal de transition, soit un lanthanide, ou un élément de la famille des actinides; leurs propriétés magnétiques sont intimement liées à leur structure cristalline qui conditionne la nature et l’intensité de ces interactions [cf. FERRITES ET GRENATS].5. Analyse chimiqueL’utilisation d’un aimant pour la recherche des minerais de fer ferromagnétiques constitue sans doute la plus ancienne application du magnétisme à l’analyse chimique. On met à profit les forces importantes produites par un aimant sur les matériaux ferromagnétiques pour enrichir les minerais de fer. Si les particules riches en fer sont constituées de magnétite, les champs magnétiques utilisés sont de l’ordre de 0,3 tesla (séparation magnétique à basse intensité), tandis que les particules d’hématite nécessitent des champs de 0,2 tesla (séparation magnétique à haute intensité). Dans ce dernier cas, après broyage, on peut transformer d’abord Fe23 en Fe34 par un grillage dit «magnétisant», ce qui permet ensuite d’effectuer une séparation magnétique à basse intensité.Les techniques magnétiques sont intéressantes chaque fois qu’un des composants du mélange possède une susceptibilité très supérieure à celle des autres: c’est le cas, en particulier, d’un constituant paramagnétique ou ferromagnétique dans un mélange diamagnétique ou d’un constituant ferromagnétique dans un mélange paramagnétique. La variation des susceptibilités en fonction de la température et du champ magnétique apporte des indications complémentaires.La détermination quantitative de la composition d’un échantillon résulte le plus souvent de l’application de la loi des mélanges, ou loi de Wiedemann, d’après laquelle la susceptibilité massique 﨑 d’un mélange est liée aux susceptibilités massiques 﨑1, 﨑2, ... et aux pourcentages pondéraux P1, P2, ... de ses constituants par l’expression: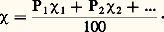 Il importe cependant de noter que, si cette loi est bien vérifiée dans le cas de mélanges mécaniques ou de solutions diamagnétiques, elle peut être en défaut pour les solutions solides et même pour les solutions liquides paramagnétiques par suite de l’interaction possible des ions entre eux et avec le solvant.Dans les cas favorables, il est possible de réaliser des dosages rapides sans destruction des échantillons: dosage d’un ion paramagnétique dans un verre, dosage de l’oxygène dans un gaz.Analyseurs d’oxygèneL’oxygène est un des rares gaz paramagnétiques avec l’oxyde nitrique, le bioxyde d’azote et le bioxyde de chlore. En l’absence de ces trois derniers gaz, la mesure de la susceptibilité d’un mélange permet de calculer aisément la concentration en oxygène, car sa susceptibilité est de 100 à 1 000 fois supérieure à celle des autres gaz.Un certain nombre d’appareils simples, de dimensions réduites et facilement transportables, fondés sur ce principe ont été commercialisés, tel celui de la firme Beckman (fig. 6). Il est constitué par une pièce de verre en forme d’haltère suspendue entre deux fils de torsion en quartz. Les deux sphères sont placées dans le gradient de champ magnétique produit par un aimant permanent; l’ensemble est entouré d’une enceinte étanche dans laquelle on fait pénétrer le gaz à analyser. Le couple magnétique est alors proportionnel à la différence des susceptibilités par unité de volume du verre et du gaz étudié; il produit une rotation du système, repérée grâce à la méthode de Poggendorf, qui est approximativement proportionnelle à la concentration en oxygène. Ces appareils permettent de réaliser en quelques secondes une mesure de concentration en oxygène avec une précision de 1 p. 100.Titrations magnétiquesDans d’autres cas, on se sert simplement de la susceptibilité magnétique lors d’une titration pour repérer le point d’équivalence, c’est-à-dire le moment à partir duquel la réaction est complète.Ainsi, lors de la titration d’une solution d’oxyhémoglobine (diamagnétique) par une solution d’hydrosulfite de sodium Na2S24 (diamagnétique), il se produit une réduction du premier composé en hémoglobine (paramagnétique). Le graphique de la figure 7 montre la variation de susceptibilité en fonction du nombre n de centimètres cubes de solution d’hydrosulfite ajoutée.Dosage du carbone dans les aciersLes caractéristiques propres au ferromagnétisme, pertes par hystérésis, champ coercitif, perméabilité réversible, sont utilisées pour doser par exemple le carbone dans les fontes et les aciers ou pour déterminer la taille des matériaux ferromagnétiques très divisés. Ces techniques qui permettent un dosage rapide et commode n’utilisent en fait que des relations empiriques entre ces propriétés magnétiques et les propriétés recherchées. Elles s’appliquent par conséquent à l’étude des matériaux analogues à ceux qui ont servi à étalonner les appareils.Critère de puretéLa grande différence de susceptibilité liée aux divers types de magnétisme peut être utilisée comme un critère de pureté qui complète de façon intéressante ceux provenant d’autres techniques comme la spectroscopie. Pour certains usages, par exemple, le cuivre doit être exempt d’impuretés ferromagnétiques qui ne peuvent être mises en évidence que par des techniques magnétiques.La mesure des susceptibilités pour suivre la séparation des terres rares présente également un grand intérêt.Analyse thermomagnétiqueL’analyse thermomagnétique, c’est-à-dire la mesure de la susceptibilité avec la température, donne des renseignements sur les transformations à l’état solide. L’établissement du diagramme nickel-molybdène en est un exemple.La variation des susceptibilités magnétiques d’alliages nickel-molybdène de compositions variées, en fonction de la température (fig. 8 b), montre des discontinuités liées à des changements de phase; en reportant sur un graphique les points composition-température correspondants, on obtient le diagramme de phase (fig. 8 a).Elle a permis également d’identifier les constituants ferromagnétiques d’un catalyseur en déterminant les températures des points de Curie correspondants, et même de les doser grâce à la mesure de l’aimantation spécifique à différentes températures comprises entre ces points de Curie.6. Cinétique et mécanique des réactions chimiquesThéoriquement, à chaque fois qu’une réaction est accompagnée d’une variation de susceptibilité magnétique, il est possible de suivre son évolution par des mesures de magnétisme statique. Cependant, cette méthode n’est intéressante que si cette variation de susceptibilité est suffisamment importante.C’est ainsi que si l’on peut suivre effectivement la polymérisation d’un certain nombre de composés organiques (cette polymérisation s’accompagnant d’une augmentation du diamagnétisme due à la disparition de doubles liaisons éthyléniques), les mesures de la viscosité, de l’indice de réfraction ou de la densité sont certainement plus commodes et plus précises. En revanche, les méthodes magnétiques peuvent être envisagées avec intérêt lorsque apparaît ou disparaît un composé paramagnétique.Le magnétisme rend de grands services dans le domaine des mécanismes de réactions chimiques. Les mécanismes théoriques interprétant la cinétique des réactions complexes font généralement intervenir des radicaux libres, et la meilleure confirmation expérimentale directe est la mise en évidence de leur paramagnétisme.Ces radicaux libres éphémères ont une durée de vie et une concentration le plus souvent trop faibles pour influer sur la susceptibilité magnétique du mélange réactionnel. Il existe cependant des exceptions: c’est le cas de la réduction (réversible) de la duroquinone par le glucose en milieu alcalin.La résonance paramagnétique électronique, plus sensible, permet de détecter de tels radicaux et même d’en déterminer la nature grâce à l’étude de la structure hyperfine. C’est ainsi que l’on a pu montrer que la polymérisation du méthacrylate de méthyle initié par le peroxyde de benzoyle faisait intervenir un radical constitué par une molécule de monomère privée d’un proton.
Il importe cependant de noter que, si cette loi est bien vérifiée dans le cas de mélanges mécaniques ou de solutions diamagnétiques, elle peut être en défaut pour les solutions solides et même pour les solutions liquides paramagnétiques par suite de l’interaction possible des ions entre eux et avec le solvant.Dans les cas favorables, il est possible de réaliser des dosages rapides sans destruction des échantillons: dosage d’un ion paramagnétique dans un verre, dosage de l’oxygène dans un gaz.Analyseurs d’oxygèneL’oxygène est un des rares gaz paramagnétiques avec l’oxyde nitrique, le bioxyde d’azote et le bioxyde de chlore. En l’absence de ces trois derniers gaz, la mesure de la susceptibilité d’un mélange permet de calculer aisément la concentration en oxygène, car sa susceptibilité est de 100 à 1 000 fois supérieure à celle des autres gaz.Un certain nombre d’appareils simples, de dimensions réduites et facilement transportables, fondés sur ce principe ont été commercialisés, tel celui de la firme Beckman (fig. 6). Il est constitué par une pièce de verre en forme d’haltère suspendue entre deux fils de torsion en quartz. Les deux sphères sont placées dans le gradient de champ magnétique produit par un aimant permanent; l’ensemble est entouré d’une enceinte étanche dans laquelle on fait pénétrer le gaz à analyser. Le couple magnétique est alors proportionnel à la différence des susceptibilités par unité de volume du verre et du gaz étudié; il produit une rotation du système, repérée grâce à la méthode de Poggendorf, qui est approximativement proportionnelle à la concentration en oxygène. Ces appareils permettent de réaliser en quelques secondes une mesure de concentration en oxygène avec une précision de 1 p. 100.Titrations magnétiquesDans d’autres cas, on se sert simplement de la susceptibilité magnétique lors d’une titration pour repérer le point d’équivalence, c’est-à-dire le moment à partir duquel la réaction est complète.Ainsi, lors de la titration d’une solution d’oxyhémoglobine (diamagnétique) par une solution d’hydrosulfite de sodium Na2S24 (diamagnétique), il se produit une réduction du premier composé en hémoglobine (paramagnétique). Le graphique de la figure 7 montre la variation de susceptibilité en fonction du nombre n de centimètres cubes de solution d’hydrosulfite ajoutée.Dosage du carbone dans les aciersLes caractéristiques propres au ferromagnétisme, pertes par hystérésis, champ coercitif, perméabilité réversible, sont utilisées pour doser par exemple le carbone dans les fontes et les aciers ou pour déterminer la taille des matériaux ferromagnétiques très divisés. Ces techniques qui permettent un dosage rapide et commode n’utilisent en fait que des relations empiriques entre ces propriétés magnétiques et les propriétés recherchées. Elles s’appliquent par conséquent à l’étude des matériaux analogues à ceux qui ont servi à étalonner les appareils.Critère de puretéLa grande différence de susceptibilité liée aux divers types de magnétisme peut être utilisée comme un critère de pureté qui complète de façon intéressante ceux provenant d’autres techniques comme la spectroscopie. Pour certains usages, par exemple, le cuivre doit être exempt d’impuretés ferromagnétiques qui ne peuvent être mises en évidence que par des techniques magnétiques.La mesure des susceptibilités pour suivre la séparation des terres rares présente également un grand intérêt.Analyse thermomagnétiqueL’analyse thermomagnétique, c’est-à-dire la mesure de la susceptibilité avec la température, donne des renseignements sur les transformations à l’état solide. L’établissement du diagramme nickel-molybdène en est un exemple.La variation des susceptibilités magnétiques d’alliages nickel-molybdène de compositions variées, en fonction de la température (fig. 8 b), montre des discontinuités liées à des changements de phase; en reportant sur un graphique les points composition-température correspondants, on obtient le diagramme de phase (fig. 8 a).Elle a permis également d’identifier les constituants ferromagnétiques d’un catalyseur en déterminant les températures des points de Curie correspondants, et même de les doser grâce à la mesure de l’aimantation spécifique à différentes températures comprises entre ces points de Curie.6. Cinétique et mécanique des réactions chimiquesThéoriquement, à chaque fois qu’une réaction est accompagnée d’une variation de susceptibilité magnétique, il est possible de suivre son évolution par des mesures de magnétisme statique. Cependant, cette méthode n’est intéressante que si cette variation de susceptibilité est suffisamment importante.C’est ainsi que si l’on peut suivre effectivement la polymérisation d’un certain nombre de composés organiques (cette polymérisation s’accompagnant d’une augmentation du diamagnétisme due à la disparition de doubles liaisons éthyléniques), les mesures de la viscosité, de l’indice de réfraction ou de la densité sont certainement plus commodes et plus précises. En revanche, les méthodes magnétiques peuvent être envisagées avec intérêt lorsque apparaît ou disparaît un composé paramagnétique.Le magnétisme rend de grands services dans le domaine des mécanismes de réactions chimiques. Les mécanismes théoriques interprétant la cinétique des réactions complexes font généralement intervenir des radicaux libres, et la meilleure confirmation expérimentale directe est la mise en évidence de leur paramagnétisme.Ces radicaux libres éphémères ont une durée de vie et une concentration le plus souvent trop faibles pour influer sur la susceptibilité magnétique du mélange réactionnel. Il existe cependant des exceptions: c’est le cas de la réduction (réversible) de la duroquinone par le glucose en milieu alcalin.La résonance paramagnétique électronique, plus sensible, permet de détecter de tels radicaux et même d’en déterminer la nature grâce à l’étude de la structure hyperfine. C’est ainsi que l’on a pu montrer que la polymérisation du méthacrylate de méthyle initié par le peroxyde de benzoyle faisait intervenir un radical constitué par une molécule de monomère privée d’un proton.
● magnétochimie nom féminin Étude des propriétés magnétiques des combinaisons chimiques et de leurs applications en chimie. (Outre la résolution de problèmes structuraux, grâce en particulier aux techniques de résonance magnétique nucléaire ou électronique, la magnétochimie est utilisée dans le triage des minerais de fer, le dosage du carbone dans les aciers, etc.)magnétochimie [maɲetoʃimi] n. f.ÉTYM. 1931; de magnéto-, et chimie.❖♦ Didact. Science qui étudie les propriétés magnétiques des corps chimiques et de leurs combinaisons.
Encyclopédie Universelle. 2012.
